¿Recuerdas que alguna vez como estudiante de la secundaria te tocara analizar este acomodo "extraño" de filas y columnas que contenían nombres aún más inusuales de sustancias químicas e infinidad de detalles y propiedades? Ahora que lo miras, es muy probable que tu respuesta sea afirmativa. En la presente entrada vamos a revisar algunos aspectos de esta tabla, que constituye una de las piedas angulares de la química.
¿Qué es la Tabla Periódica?
Digamos que se trata de un esquema o arrehlo donde han sido colocados todos los elementos químicos conocidos hasta hoy, con un orden y una ubicación que nos hablan de los atributos, características y relaciones de semejanza entre ellos. Se denomina "periódica" porque en ella podemos advertir que las propiedades de dichos elementos tienden a repetirse en función de un número entrero de cuadros o posiciones.
Esta tabla periódica posee una importancia capital en la química, ya que ha permitido clasificar, ordenar y conocer la naturaleza y relaciones de las sustancias básicas que conforman prácticamente la totalidad de materia del universo conocido por el hombre.
Esta tabla periódica posee una importancia capital en la química, ya que ha permitido clasificar, ordenar y conocer la naturaleza y relaciones de las sustancias básicas que conforman prácticamente la totalidad de materia del universo conocido por el hombre.
Historia de la Tabla Periódica
El ser humano siempre ha sido curioso e inquisitivo con respecto a todo lo que le rodea. Desde épocas muy remotas se preguntó acerca de la composición de las cosas, y en un principio estableció que eran cuatros sus elementos: agua, tierra, aire y fuego. Sin embargo, fueron necesarios muchos siglos de observación y paciente investigación para reconocer el hecho fundamental de que la naturaleza tiene en realidad una constitución mucho más rica y variada. Se descubrió la existencia de elementos químicos (su número total era desconocido) que se unen y recombinan para generar la vasta red de sustancias del universo.
Una vez reconocida la realidad científica de estos bloques de la materia, era necesario encontrar entonces un sistema que pudiese catalogarlos y fijar sus relaciones. La cuestión era cuál sería un criterio natural y lógico para ello. Así surgieron los primeros intentos de tablas periódicas de los elementos químicos, basadas en una o varias propiedades de estos.
I. Arreglo de Döbereiner: Ley de las tríadas
Este químico alemán tuvo el primer atisbo de una tabla periódica al hallar una relación significativa entre la masa de los elementos y sus respectivas propiedades químicas.
Al trabajar con grupos de tres (tríadas) de elementos, como el cloro, el bromo y el yodo, se encontró con que existía una variación gradual entre los pesos atómicos, desde el primero hasta el tercero de ellos. Y aun pudo advertir que la tríada cloro-bromo-yodo tiene 36,80 y 127 unidades de peso respectivamente. Si realizamos la suma de los valores extremos, es decir 36 + 127, y la dividimos entre 2, el resultado es 81, o lo que es lo mismo, un número muy próximo a 80, que casualmente es el número de masa del elemento de en medio, es decir, del bromo, hecho que hace que encaje perfectamente en el ordenamiento de la tríada. Expresado de otra manera, la media aritmética de los números de masa del primer y el tercer elemento nos proporciona el valor del número de masa del elemento de la parte media.
Döbereiner hizo un intento de relacionar las propiedades y semejanzas químicas de los elementos y de sus compuestos, con las características atómicas de cada uno de ellos, que en ese caso se trataba de los pesos atómicos, viéndose un gran parecido entre ellos, y una variación progresiva desde el primero hasta el tercero o último de la tríada. El químico alemán también encontró que existían más tríadas de elementos semejantes a la del cloro-bromo-yodo, que cumplían con este principio, por eso a su trabajo se le conoce en la historia como la Ley de las tríadas.
Al trabajar con grupos de tres (tríadas) de elementos, como el cloro, el bromo y el yodo, se encontró con que existía una variación gradual entre los pesos atómicos, desde el primero hasta el tercero de ellos. Y aun pudo advertir que la tríada cloro-bromo-yodo tiene 36,80 y 127 unidades de peso respectivamente. Si realizamos la suma de los valores extremos, es decir 36 + 127, y la dividimos entre 2, el resultado es 81, o lo que es lo mismo, un número muy próximo a 80, que casualmente es el número de masa del elemento de en medio, es decir, del bromo, hecho que hace que encaje perfectamente en el ordenamiento de la tríada. Expresado de otra manera, la media aritmética de los números de masa del primer y el tercer elemento nos proporciona el valor del número de masa del elemento de la parte media.
Döbereiner hizo un intento de relacionar las propiedades y semejanzas químicas de los elementos y de sus compuestos, con las características atómicas de cada uno de ellos, que en ese caso se trataba de los pesos atómicos, viéndose un gran parecido entre ellos, y una variación progresiva desde el primero hasta el tercero o último de la tríada. El químico alemán también encontró que existían más tríadas de elementos semejantes a la del cloro-bromo-yodo, que cumplían con este principio, por eso a su trabajo se le conoce en la historia como la Ley de las tríadas.
Fuente:
II. Chancourtois- Newlands: Ley de las octavas
El geólogo francés Chancourtois realizó un nuevo arreglo de los elementos químicos relacionado con su masa atómica. En un cilindro vertical enrolló su configuración particular donde evidenciaba de nuevo la periodicidad química de los elementos, pues en una misma columna vertical aparecían elementos de propiedades similares.
Más tarde, junto al químico inglés Newlands, postularía un nuevo orden llamado Ley de las octavas, que anunciaba la repetición de las propiedades químicas en un periodo de ocho elementos que eran análogos a una escala musical ascendente. El inconveniente de este esquema es que no iba más allá del elemento calcio. Pero sentó un precedente muy importante al demostrar que era posible ordenar a los elementos químicos según un sistema racional.
3. TABLA DE MENDELEIEV
Se trata de una antecesora directa de nuestra tabla periódica actual. Este químico ruso estableció la existencia de una relación entre la masa atómica de los elementos y sus propiedades químicas, y que estas propiedades tienen una periodicidad o repetición. Así que diseñó un cuadro que contenía un total de 63 elementos químicos (los que se conocían entonces).
Este arreglo presentaba tres adelantos notables:
- Orden creciente conforme a las masas atómicas
- Agrupación en filas
- Agrupación en columnas de elementos con características semejantes
Como esta tabla presentaba "huecos" considerables, Mendeleiev tuvo que aventurar una explicación: dichas lagunas eran debidas al hecho de que aún faltaba elementos químicos por descubrir, y que cuando estos fueran hallados podrían ocupar las posiciones vacantes; incluso predijo algunas propiedades físicas y químicas que tales elementos tendrían. La historia demostraría que el ruso estaba acertado.
La tabla de Mendeleiev presentaba además algunas inconsistencias a causa de algunos defectos en la determinación de masas atómicas propios de su época. Pero con todo esto, sigue siendo históricamente determinante al haber orientado la indagación en la dirección que conduce a la tabla que hoy poseemos.
4. TABLA PERIÓDICA MODERNA
El británico Mosseley daría un paso más en el establecimiento de nuestra tabla periódica, pues propuso que los elementos podrían ser ordenados en base a sus números atómicos (criterio considerado antes arbitrario), y no en sus masas. Con este nuevo arreglo desaparecían por fin algunos errores de los esquemas anteriores.
El planteamiento de Mosseley condujo a establecer la llamada Ley Periódica: Las propiedades de los elementos son una función periódica de sus números atómicos. Estamos ya frente al criterio que originaría la tabla periódica que actualmente estudias en el M9
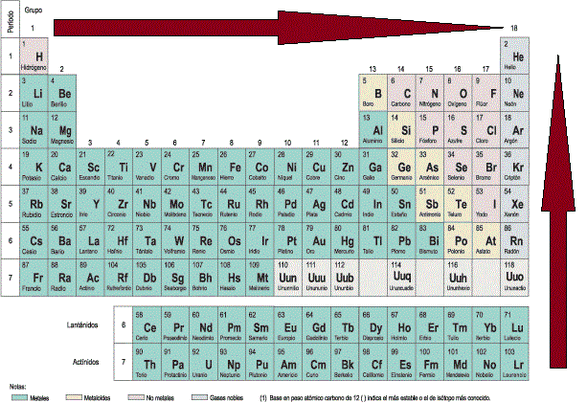
Estructura de la tabla periódica actual
Siguiendo el criterio de la Ley periódica, los elementos de nuestra tabla moderna presentan la siguiente disposición:
- Se ordenan de manera ascendente según sus números atómicos
- Se acomodan en 7 filas filas horizontales, llamadas periodos
- Se arreglan en 18 columnas verticales, denominadas grupos o familias
Las familias de elementos químicos presentan gran parecido de sus integrantes entre sí en cuanto a muchas de sus propiedades. Se han enumerado utilizando las cifras romanas y una letra "A" o "B". La A nos muestra a elementos representativos; la B nos habla de un bloque central de elementos de transición. Pero hoy se prefiere el sistema más práctico de la IUPAC de contabilizar las familias de izquierda a derecha simplemente con números del 1 al 18.
Hay dos filas en la parte inferior separadas del cuerpo de la tabla. Reciben el nombre de serie de Lantánidos y serie de Actínidos, pues vienen a ser una sucesión de elementos con las mismas propiedades de los elementos Lantano y Actinio respectivamente. Se conocen también como elementos de transición interna.
 |
CLIC PARA AGRANDAR Y REVISAR FAMILIAS |
En este enlace podrás explorar de un modo más dinámico esta estructura:
Veamos los nombres y propiedades de las familias que componen la tabla periódica
- GRUPO IA (1): Metales alcalinos: Exceptuando al hidrógeno, que es un gas, comprende al litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr). Se trata de metales blandos y grisáceos de baja densidad, buenos conductores de calor y electricidad, son solubles en agua.
- GRUPO IIA (2): Metales alcalinotérreos: Conformada por el berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba) y radio (Ra). Reciben su nombre por las propiedades alcalinas o básicas de sus "tierras". Son metales de muy baja densidad, buenos conductores de electricidad, y possen dos electrones de valencia.
- GRUPOS IB AL VIII B (3-12): Son todas las columnas del centro de la tabla periódica, y se agrupa en ellas a todos los elementos conocidos como metales de transición. Comprende algunos de los elementos que asociamos con la palabra "metal" por poseer brillo y ser buenos conductores de la electricidad. Unos son muy estimados por el hombre, como el oro (Au) y la plata (Ag). Incluimos también la serie de lantánidos (tierras raras) y los actinidos,que abarcan elementos inestables o radioactivos como el uranio y el plutonio.
- GRUPO IIIA (13): Se denomina grupo de los metales térreos. Familia encabezada por el boro (B), que es un elemento metaloide, le siguen en orden descendente elementos de atributos metálicos, como el aluminio (Al), ampliamente utilizado en la industria, y cuya abundancia en nuestro planeta da el nombre a toda la familia; luego el galio (Ga), indio (In) y el talio (Tl).
- GRUPO IVA (14): Se conoce como familia del carbono o carbonoideos, por ser el elemento carbono (C) el que encabeza el grupo. Le siguen en orden descendente el silicio (Si), el germanio (Ge), el estaño (Sn) y el plomo (Pb). Cabe mencionar que el carbono es un elemento importantísimo pues constituye la base orgánica de todos los seres vivos, al tiempo que lo encontramos en la atmósfera y en la corteza terrestre en forma de grafito y diamante. El silicio, por su parte, posee gran importancia industrial.
- GRUPO VA(15): Conocido como grupo del nitrógeno o nitrogenoides.Conformado por el nitrógeno (N), fósforo (P), arsénico (As), antimonio (Sb) y bismuto (Bi). Destacan del grupo el nitrógeno, que constituye la mayor parte la composición de la atmósfera terrestre (78%), con su propio ciclo biogeoquímico, presente también como un bioelemento, y utilizado en aplicaciones industriales. Y el fósforo, presente en algunos alimentos como mariscos, huevo y productos lácteos; y como base de fertilizantes y plaguicidas.
- GRUPO VIA (16): Recibe nombres diversos: anfígenos, calcógenos y familia del oxígeno, por ser este el elemento que lo encabeza, seguido hacia abajo de azufre (S), selenio (Se), telurio (Te) y polonio (Po). Se trata de elementos que van de los no metales a los metales conforme descienden. El oxígeno es desde luego el gas que respiramos gran número de seres vivos, y se halla presente en el agua. El azufre, por su parte, es un sólido amarillo de olor típico a huevo podrido, con diversos usos y aplicaciones en la industria, desde fertilizantes hasta medicinas. Participa en la constitución de gran variedad de organismos (incluidos los humanos), y tiene su propio ciclo biogeoquímico.
- GRUPO VIIA (17): Famiia de elementos conocidos como los halógenos (formadores de sales). Se constituye en orden descendente por el flúor (F), cloro (Cl), bromo (Br), yodo (I) y astato (At). Sus integrantes poseen siete electrones de valencia, y por ello solo necesitan uno más para completar el octeto. Se presentan como moléculas diatómicas. Son altamente elctronegativos.
- GRUPO VIIIA (18):Llamado familia de los gases nobles, es un grupo de elementos químicos con propiedades muy semejantes: suelen ser gases inertes, monoatómicos inodoros, incoloros y no reaccionan con otros elementos. Los gases nobles son helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe), el radiactivo radón (Rn) ...
El neón, argón, kriptón y xenón se obtienen del aire usando los métodos de licuefacción y destilación fraccionada. El helio es típicamente separado del gas natural y el radón se aísla normalmente a partir del decaimiento radioactivo de compuestos disueltos del radio. Los gases nobles tienen muchas aplicaciones importantes en industrias como iluminación, soldadura y exploración espacial. La combinación helio-oxígeno-nitrógeno (trimix) se emplea para respirar en inmersiones de profundidad para evitar que los buzos sufran el efecto narcótico del nitrógeno. Después de verse los riesgos causados por la inflamabilidad del hidrógeno, éste fue reemplazado por helio en los dirigibles y globos aerostáticos. (Wikipedia)
Abajo cuentas con un enlace donde podrás acceder a una tabla periódica interactiva que te mostrará mucho de la información antes expuesta y más.
 |
CLIC PARA EXPLORAR |
Metales, no metales y semimetales...
Por todo lo mostrado anteriormente, vemos que los elementos químicos son sustancias que presentan ciertas características visibles que los pueden reagrupar en bloques aún más grandes y genéricos que las familias o periodos.
LOS METALES: Son elementos que presentan en conjunto algunas características ya mencionadas. Se ubican en la parte izquierda y media de la tabla periódica
- Son buenos conductores del calor y la electricidad
- Algunos tienen propiedades magnéticas (son atraídos por imanes)
- Suelen ser maleables y dúctiles
- Alta densidad
- Puntos de fusión altos
- Algunos poseen brillo característico
- Son todos sólidos a temperatura ambiente, excepto el mercurio (Hg), que es líquido
- Poseen bajas energías de ionización, con lo que tienen la tendencia a perder electrones (se oxidan)
- Son electropositivos
LOS NO METALES: Posicionados en la parte derecha de la tabla. Se trata de elementos de aspecto físico variable que exhiben en grupo algunas propiedades que resultan contrarias a las de los metales(de ahí su nombre), como:
- No son buenos conductores del calor y la electricidad ni poseen brillo
- Son de baja densidad
- Puntos de fusión relativamente bajos
- Frágiles y no son maleables ni dúctiles
- La mayoría son sólidos a temperatura ambiente; el bromo (Br) es líquido, y el nitrógeno(N) , oxígeno (O), flúor(F), cloro (Cl) e hidrógeno (H), gases
- Poseen altas energías de ioinización, con lo cual tienen la tendencia a ganar electrones (se reducen)
- Son electronegativos
- Algunos de ellos existen como moléculas diatómicas
LOS SEMIMETALES O METALOIDES: Dentro de la tabla periódica los metaloides se encuentran en línea diagonal desde el boro al polonio. Los elementos que se encuentran encima a la derecha son no metales, y los de debajo a la izquierda, metales. Hablamos de elemementos que muestran propiedades de metales y no metales (unas veces pueden ser semiconductores), por lo que resulta imposible clasificarlos en alguno de los grupos anteriores.
Son considerados metaloides o semimetales los siguientes elementos:
Son considerados metaloides o semimetales los siguientes elementos:
Boro (B), silicio (Si), germanio (Ge), arsénico (As), antimonio (Sb), telurio (Te) y polonio (Po)
El Silicio por
ejemplo tiene lustre, pero no es maleable ni dúctil, sino que es
quebradizo como muchos no-metales. Además es menos un mal conductor de
la electricidad o el calor. Los Metaloides se usan muy a menudo en la industria de los semiconductores (procesadores y memoria de las computadoras
El germanio es un elemento químico con número atómico 32, y símbolo Ge perteneciente al grupo 14 de la tabla periódica de los elementos.
Las
aplicaciones del germanio se ven limitadas por su elevado coste y en
muchos casos se investiga su sustitución por materiales más económicos.
https://sites.google.com/site/quimicaiiepoem/3-1-2-metales-no-metales-y-semimetales
En el siguiente enlacer podrás explorar algunas propiedades de todos los bloques de elementos químicos:
http://www.ptable.com/?lang=es#Property/State
Electronegatividad, electropositividad, energía de ionización y radios atómicos
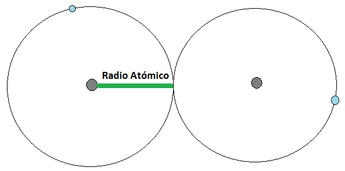
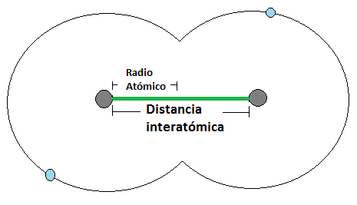
EL RADIO ATÓMICO se define como la distancia media que existe entre los núcleos atómicos de dos átomos que se encuentren unidos mediante un enlace . Para los átomos que se unan mediante una cesión de electrones, el radio atómico correspone a la distancia indicada en la Imágen 12 (a) [izquierda], mientras que los que se unan mediante una compartición de electrones, el radió atómico se representa tal y como apárece en la Imágen 12 (b) [derecha]. Para ilustrar el concepto, se considera al átomo como una esfera.
Imágen 12: Radio Atómico. Las pelotas grises son los núcleos atómicos, mientras las bolas celestes son el electrón mas externo.
|
(a)
|
(b)
|
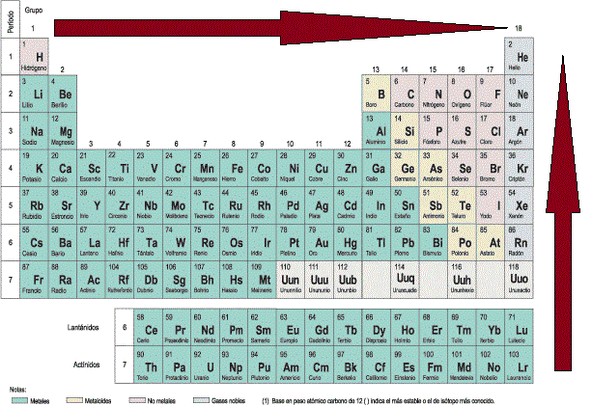
El radio atómico de los elementos químicos aumenta en la tabla periódica de derecha a izquierda en los periodos, y de arriba abajo en los grupos o familias.
ELECTRONEGATIVIDAD:
Es una de las propiedades más importantes para la química, ya que es
esta propiedad la que explica el tipo de enlace químico en un compuesto y
las propiedades de reacción de estos. La electronegatividad se puede
definir como capacidad que tiene un elemento para atraer electrones o densidad electrónica cuando forma un enlace. La electronegatividad aumenta de izquierda a derecha en los periodos, y de abajo arriba en los grupos o familias.
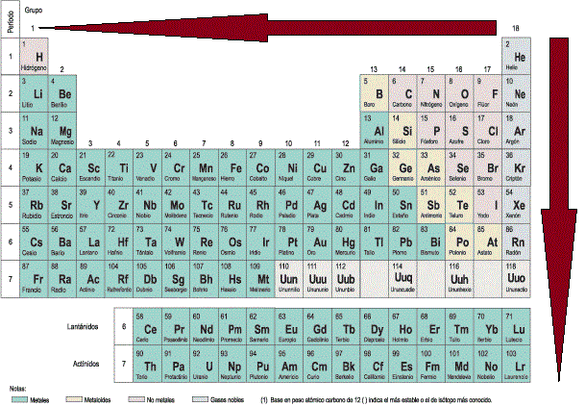
ELECTROPOSITIVIDAD: Resulta ser lo contrario a la electronegatividad es decir, la capacidad de un elemento de ceder electrones o densidad electrónica
y por lo tanto, crece en direcciones contrarias a su opuesto, o sea,
aumenta al bajar por un grupo y disminuye al avanzar en un período (ver imagen).
Si bien, mirando la tabla periódica, se diría que el Francio (Fr) es el
elemento más electropositivo, se considera por lo general al Cesio (Cs)
como tal, debido a que el Francio es radiactivo y se descompone
fácilmente en otros elementos.
POTENCIAL O ENERGÍA DE IONIZACIÓN: Corresponde a la energía necesaria que se debe administrar a un elemento para que ceda su electrón más externo. Cada elemento polielectrónico tiene tantos potenciales de ionización como electrones tenga, siendo siempre el primer potencial el menor de todos y va aumentando a medida que se van quitando los electrones, es decir, se va haciendo cada vez más difícil extraer los electrones que están más cerca del núcleo que los que están más alejados de éste. Como un aumento de energía implica dificultad, los no-metales (ubicados al costado derecho de la tabla periódica) poseen las energías más altas, por lo cual el potencial de ionización aumenta a medida que se avanza en un periodo (de izquierda a derecha en la tabla); mientras que a medida que un átomo se hace más grande es más sencillo extraer su electrón más alejado, ya que este se siente menos atraído hacia el núcleo, por lo cual la energía de ionización disminuye a medida que se baja en un grupo, todo esto se ve resumido en la imagen.
http://es-puraquimica.weebly.com/electropositividad-y-potencial-de-ionizacion.html
Descárgate aquí gratis una excelente tabla periódica para este y otros temas del M9: UNIVERSO NATURAL
¡EL ÉXITO TE ACOMPAÑE EN TODO!
 |
DESCARGA LA TABLA |
¡EL ÉXITO TE ACOMPAÑE EN TODO!












No hay comentarios.:
Publicar un comentario